Trova la massa atomica relativa per ciascun elemento della molecola. Per questa operazione sfrutta una copia della tavola periodica degli elementi, sulla quale puoi leggere la massa atomica di ogni elemento proprio sotto il relativo simbolo chimico; per esempio, quella dell’ossigeno è pari a 15,9994 u.. Per il diossido di carbonio (CO 2), la relativa massa atomica è 12,011 u per il carbonio.. 3. Moltiplica la massa atomica relativa per la costante di massa molare. Questa viene definita come 0,001 chilogrammi per mole, cioè 1 grammo per mole. In questo modo converti le unità atomiche nella corretta unità di misura (g/mol). Di conseguenza la massa molare dell’idrogeno è 1,007 g/mol; quella del carbonio 12,0107 g/mol, quella dell.

PPT La misura delle grandezze PowerPoint Presentation, free download ID3011611

Come Calcolare la Massa Molare 7 Passaggi (Illustrato)

Cos’è la massa molare? Qual è lo

PPT Molecole e moli PowerPoint Presentation, free download ID4580998

come si calcola il volume avendo massa e densità DrBeckmann

PPT “La Mole” Principi di stechiometria PowerPoint Presentation, free download ID4354029
Chimica la tavola periodica degli elementi

Come si calcola il volume con massa e densita ilmessaggeero
PPT Molecole e moli PowerPoint Presentation, free download ID4580998

Come si calcola la mole ilmessaggeero

PPT ESERCITAZIONE di CHIMICA 15 ottobre 2012 MOLE PERCENTUALE IN MASSA ANALISI ELEMENTARE

PPT LA QUANTITÀ CHIMICA PowerPoint Presentation, free download ID3248544

PPT Massa atomica relativa PowerPoint Presentation, free download ID5804595

Come Calcolare la Massa Molare 7 Passaggi (Illustrato)

Come Calcolare la Massa Molare 7 Passaggi (Illustrato)

CONCENTRAZIONE DI UNA SOLUZIONE Frazione molare Molalità Molarità tot n soluto n x kg di

Come Calcolare la Massa di un Oggetto 9 Passaggi

PPT LA QUANTITÀ CHIMICA PowerPoint Presentation, free download ID3248544

PPT “La Mole” Principi di stechiometria PowerPoint Presentation, free download ID4354029

PPT Calcoli applicati alla chimica analitica PowerPoint Presentation ID4086138
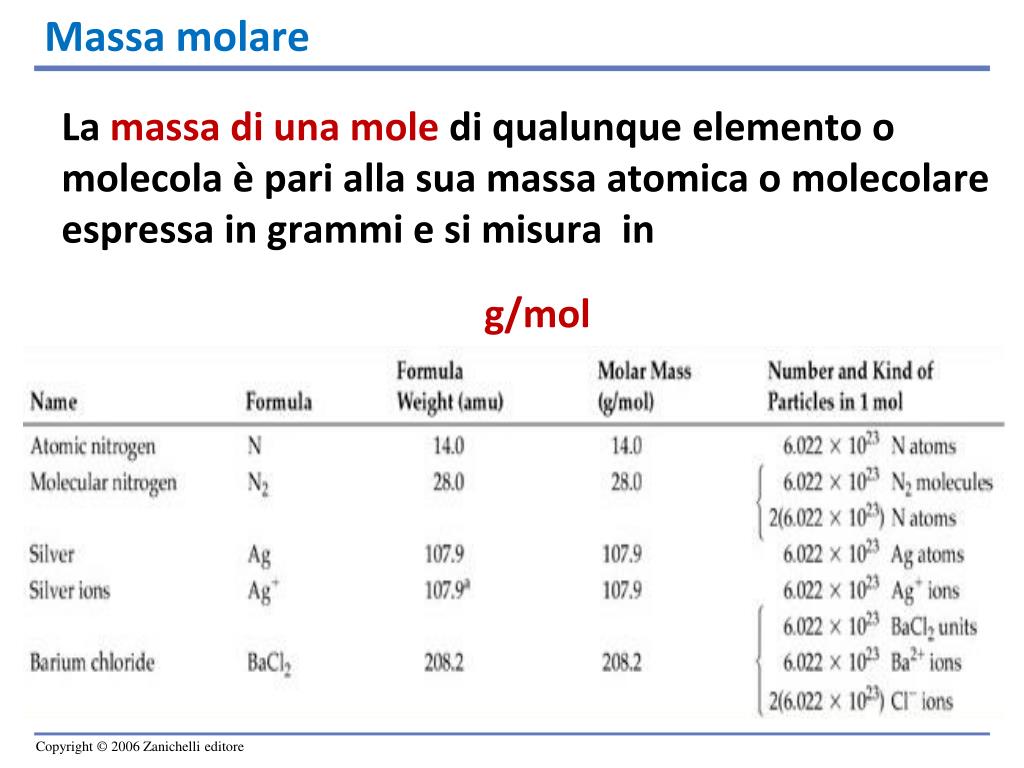
Come si calcola la massa molare esempi? Ad esempio, per calcolare la massa molare dell’acqua (H2O), si somma la massa atomica dell’idrogeno (H) moltiplicata per 2 (poiché ci sono 2 atomi di idrogeno) e la massa atomica dell’ossigeno (O). Quindi, la massa molare dell’acqua è 2 * massa dell’idrogeno + massa dell’ossigeno.. La formula è la seguente: Massa = massa molecolare x moli Ad esempio, se si conosce la massa molecolare di una sostanza e si hanno 2 moli di essa, si può calcolare la massa moltiplicando la massa molecolare per 2. Tuttavia, senza specificare la sostanza di cui si sta parlando, non è possibile fornire una risposta esatta.